Igel-Tanreks (Echinoptis telfairi)
|
Bei diesen süßen kleinen Wesen handelt es sich um "Kleine Igel-Tanreks" (engl. Tenreks). Sie leben eigentlich auf Madagaskar, klettern dort auf Bäumen umher und ernähren sich von Wirbellosen (Insekten, Maden, Würmer). Die Tenreks sind eine Familie aus der Ordnung der Tenrekartigen (Afrosoricida), die als direkte Verwandte der Tenreks die Otterspitzmäuse (Potamogalidae) und als beiden nahe verwandt die Goldmulle (Chrysochloridae) enthält. Die Tenrekartigen wiederum gehören zur Überordnung der Afrotheria, einer der vier Hauptlinien innerhalb der Höheren Säugetiere. Die Afrotheria stellen eine Verwandtschaftsgruppe aus überwiegend in Afrika beheimateten oder ursprünglich von dort stammenden Tieren dar. Ihre Zusammengehörigkeit beruht vor allem auf genetischen Untersuchungen, das Aussehen ist sehr unterschiedlich. Eine der nächsten Verwandschaftsgruppen sind bezeichnenderweise die heutigen Elefanten, die Schliefer und die Seekühe. Tanreks sehen auf den ersten Blick aus wie Igel, sind aber keine und sie verhalten sich auch nicht so. Sie können sich extrem flasch machen, durch Splaten kriechen und überstehen auch einen Fall vom Baum ziemlich gut. Sie sind Raubtiere haben ziemlich lange Reißzähne und können damit herzhaft zubeißen. |
 |
Ein-Igeln und Ausigeln
Ab und an muss sich jeder mal Abschotten, aber irgendwann sollte man sich auch wieder öffnen.Die Igeldame Buffy machts vor, als sie erkennt, dass es nur eine harmlose Kontrolluntersuchung werden soll.
 |
 |
 |
Tanreks klettern gerne und brauchen Bewegung
Daher sollten die Terrarien Raum und Klettermöglichkeiten bieten. Rauhes Holz oder Drahtgitter eignen sich besonders gut für Klettertouren und Laufräder an denen die Tanreks nicht mit den Krallen hängen bleiben können erlauben Ausdauertraining und Beschäftigung.
Ein bißchen Grün zur Deko gefällt dem Betrachter und die Tanreks haben Spaß beim Erkunden.
 |
 |
 |
 |
 |
 |
Erwachsene Tanreks
Ausgewachsene Tanreks sind ca. 160 bis 220 g schwer und passen ziemlich gut in eine Hand. Sie sind nachtaktiv und halten Winterschlaf, wenn sie dick genug sind. Da sie ihre Körpertemperatur nicht gut regeln können, sondern diese der Außentemperatur anpassen, brauchen sie im Terrarium Wärmesteine oder Lampen. Auf diesen ruhen sie sich gerne aus oder halten ein Nickerchen. Aufgewärmt dagegen sind sie sehr agil.
| Adultes Weibchen | Adultes Weibchen beim Aufwärmen | Adultes Weibchen |
 |
 |
 |
| Adultes Männchen im Rotlicht | Adultes Männchen (ausbruchsflach) | Adultes Männchen |
 |
 |
 |
| Adultes Weibchen auf Erkundung | Adultes Männchen (Reißzähne sichtbar) | Teeni-Weibchen versucht sich an Fledermausschlaf |
 |
 |
 |
Tanrek Hygiene ohne Desinfektionsmittel
Tanreks lieben frische Sandbäder und reinigen sich darin ausgiebig ihr Stachelkleid. Das geht allein aber auch zu zweit oder zu dritt.
|
|

|
|
Tanrek Nachwuchs
Tanrek Nachwuchs ist unfassbar niedlich und die Kleinen wachsen enorm schnell. Um zu kontrollieren, ob alle Jungen ausreichend gesäugt werden, wurden wir die Kleinen anfangs fast täglich und später in größeren Abständen gewogen. Dabei wurden dann auch diese Bilder gemacht, um die Entwicklung festzuhalten. Tanreks kommen blind und ohne Stacheln auf die Welt. Aber schon nach 2 Tagen fangen die Stacheln an zu wachsen und man kann tatsächlich fast zusehen wie diese länger werden. Nach ca. 10 Tagen öffenen sie die Augen und sind dann sofort damit beschäftigt die Umgebung zu erkunden und zu klettern.
| Trächtige Tanrekmama | Aufmerksame Mutter nach der Geburt | Neugeborene Tanrek-Babys |
 |
 |
 |
| Tag 1 | Tag 1 | Tag 1 |
 |
 |
 |
| Tag 2 | Tag 2 | Tag 2 |
 |
 |
 |
| Tag 5 | Tag 5 | Tag 5 |
 |
 |
 |
| Tag 6 | Tag 6 | Tag 6 |
 |
 |
 |
| Tag 7 | Tag 7 | Tag 7 |
 |
 |
 |
| Tag 8 | Tag 8 | Tag 8 |
 |
 |
 |
| Tag 9 | Tag 9 | Tag 9 |
 |
 |
 |
| Tag 10 | Tag 10 | Tag 10 |
 |
 |
 |
| Tag 12 | Tag 12 | Tag 12 |
 |
 |
 |
| Tag 13 | Tag 13 | Tag 13 |
 |
 |
 |
| Tag 14 | Tag 14 | Tag 14 |
 |
 |
 |
| Tag 15 | Tag 15 | Tag 15 |
 |
 |
 |
 |
 |
 |
| Tag 16 | Tag 16 | Tag 16 |
 |
 |
 |
| Tag 17 | Tag 17 | Tag 17 |
 |
 |
 |
 |
 |
 |
| Tag 20 | Tag 20 | Tag 20 |
 |
 |
 |
| Tag 22 | Tag 22 | Tag 22 |
 |
 |
 |
| Tag 25 | Tag 25 | Tag 25 |
 |
 |
 |
 |
 |
 |
| Tag 26 | Tag 26 | Tag 26 |
 |
 |
 |
 |
 |
 |
Tanrek Ernährung
Tanreks fressen Maden (z.B. Käferlarven, Mehlwürmer, Zophobas) und Insekten (Heuschrecken, Grillen, Heimchen). Im Winter kann man ihnen zusätzlich auch Igelfutter geben, damit sie immer Futter finden, wenn sie zwischendurch aufwachen. Zum Aufpepelln darf man ihnen Rührei oder Fleischstücken geben. Ab und an fressen sie auch mal ein Madarinenstück oder beißen in eine Pflanze.
 |
 |
 |
Coating (Beschichtungen) für Zellkultur-Plastik
Als Coating oder Beschichtung von Zellkulturplastik bezeichnet man alle Oberflächenmodifikationen zur Adhäsion, die über die Corona- oder Plasmabehandlung beim Hersteller hinausgehen. Beide Begriffe werden synonym benutzt.
Typen von Beschichtungen in der Zellkultur
Wie hier beschrieben, besteht praktisch jedes Zellkultur-Plastik aus Polystyrol und wird von jeweiligen Hersteller zur Verbesserung der Zellanheftung oberflächenbehandelt. Trotz allem ist diese Oberfläche jedoch keine annähernd natürliche Oberfläche wie Zellen sie im Gewebe vorfinden können. D.h. die Komplexität des Zellkulturmodels in Bezug auf die Adhäsionsoberfläche kann von einfach bis histotypisch (gewebeähnlich) reichen:
- Unbehandeltes Polystyrol (Bakterienschalen), hydrophob und nur für wenige Zelltypen anwendbar (z.B. Schilddrüsenzellen, Keratinozyten)
- Oberflächenbehandeltes Polystyrol (normales Zellkulturplastik), polar und/oder geladen je nach Hersteller
- Einfache, künstliche, kostengünstige Beschichtung
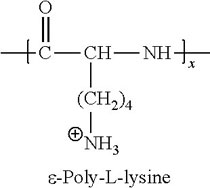
x Poly-L-Lysin, Poly-D-Lysin
x Poly-Ornithin - Einfache, kostengünstige, unspezifisch proteinäre Beschichtung
x Gelatine - Spezifische extrazelluläre Matrixbeschichtung mit einem Protein (teurer,
meist Isolate aus tierischem Gewebe))
x Collagen I, IV
x Fibronektin
x Laminin
x Vitronektin
x Osteopontin - Spezifische Teilsequenzen extrazellulärer Matrixproteine (teilweise noch
teurer, teilweise GMP-konform, da synthetisch hergestellt)
x RGD-Motive
x Fibronektin-Domänen - Spezifische, komplexe Matrixbeschichtung
x Matrigel (mehrere Komponenten der extrazellulären Matrix mit gebundenen Wachstumsfaktoren etc.) - 3D Modelle in denen die Zellen in eine Matrix oder ein Gel eingebettet
sind, u.a.
x Collagengele
x Matrigele
x Alginatgele
x Lactatgele
Warum verwendet man Coatings ?
Beschichtungen sind aufwendiger und teurer als die Kultur in normalen Zellkulturgefäßen. Für die meisten Grundlagenexperimente mit Zelllinien ist eine künstliche Oberfläche ausreichend, jedoch gibt es verschiedene Gründe aus denen man auf aufwendigere beschichtete oder gecoatete Oberflächen wechselt:
- Ohne Beschichtung haften die Zellen nicht oder sehr schlecht (Primäre Neurone, Oligodendrozyten, Hepatocyten)
- Die Beschichtung verhindert das Abwaschen der Zellen im Assay (HEK293, OLN93, HepG2)
- Die Beschichtung trägt zur Differenzierung der Zellen bei (Neurone, Glia, Keratinocyten, Hepatocyten)
- Ohne Beschichtung werden die Zellen seneszent oder dedifferenzieren (MSC, Hepatocyten)
- Die Zellen bilden auf der Beschichtung eine komplexere Morphologie (Glia, Neuronen, Hepatozyten, HepG2, Keratinozyten)
- Die Zellen polarisieren nur auf der Beschichtung (Schilddrüsenzellen, Hepatocyten, Keratinocyten)
- Es wird mit serumfreien Medien gearbeitet und die Zellen können ohne Beschichtung nicht überleben, proliferieren oder adhärieren (s.u.) (MSC, Stammzellen)
- Die Fragestellung ist sehr spezifisch und kann nur in einem echten 3D-Model beantwortet werden (Hautmodelle, Sphäroide, Angiogenese, Knochen, Knorpel)
Generell wachsen alle Zellen lieber und meist auch besser auf einer beschichteten als unbeschichteten Oberfläche. D.h. der Experimentator entscheidet je nach Fragestellung und Notwendigkeit. Für anspruchslose Zelllinien besteht nicht die Notwendigkeit zur Beschichtung daher nutzt man ungecoatetes Plastik. Bei anspruchsvolleren Linien und speziell Primärzellen dagegen ist oft eine Beschichtung für die normale Zellkultur hilfreich und manchmal sogar unabdingbar ist. Je "näher" außerdem die Umgebung der Zellen an der natürlichen Gewebesituation ist, umso übertragbarer sind dann natürlich auch die Ergebnisse.
Anwendungsbeispiele für Beschichtungen
Serumfreie oder xenofreie Zellkultur von MSCs (mesenchymalen Stammzellen)
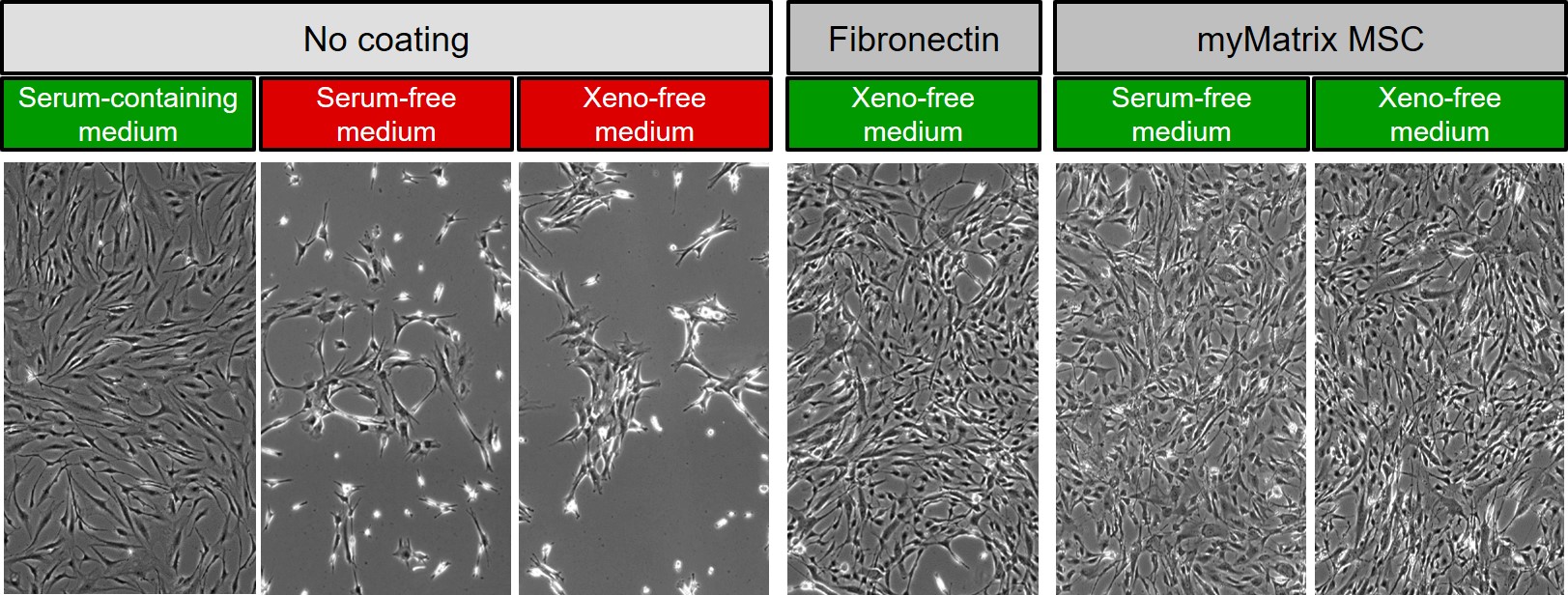
In den nachfolgenden Abbildung von denovoMATRIX sieht man wie für die Kultur von mesenchymalen Stammzellen (MSC) mit dem Wechsel von einem FCS- oder serumhaltigen Medium zu einem serumfreien oder Xeno-freien Medium die Notwendigkeit eines Coatings entsteht. Die anspruchsvollen MSC können nicht an das Zellkulturplastik anheften, wenn ihnen Serumproteine fehlen, die dies ermöglichen. Dies wird durch die Beschichtung ausgeglichen.
|
© denovoMATRIX modified by InCelligence |
Kultur von humanen Fibroblasten auf verschiedenen Oberflächen mit FCS-haltigem Medium
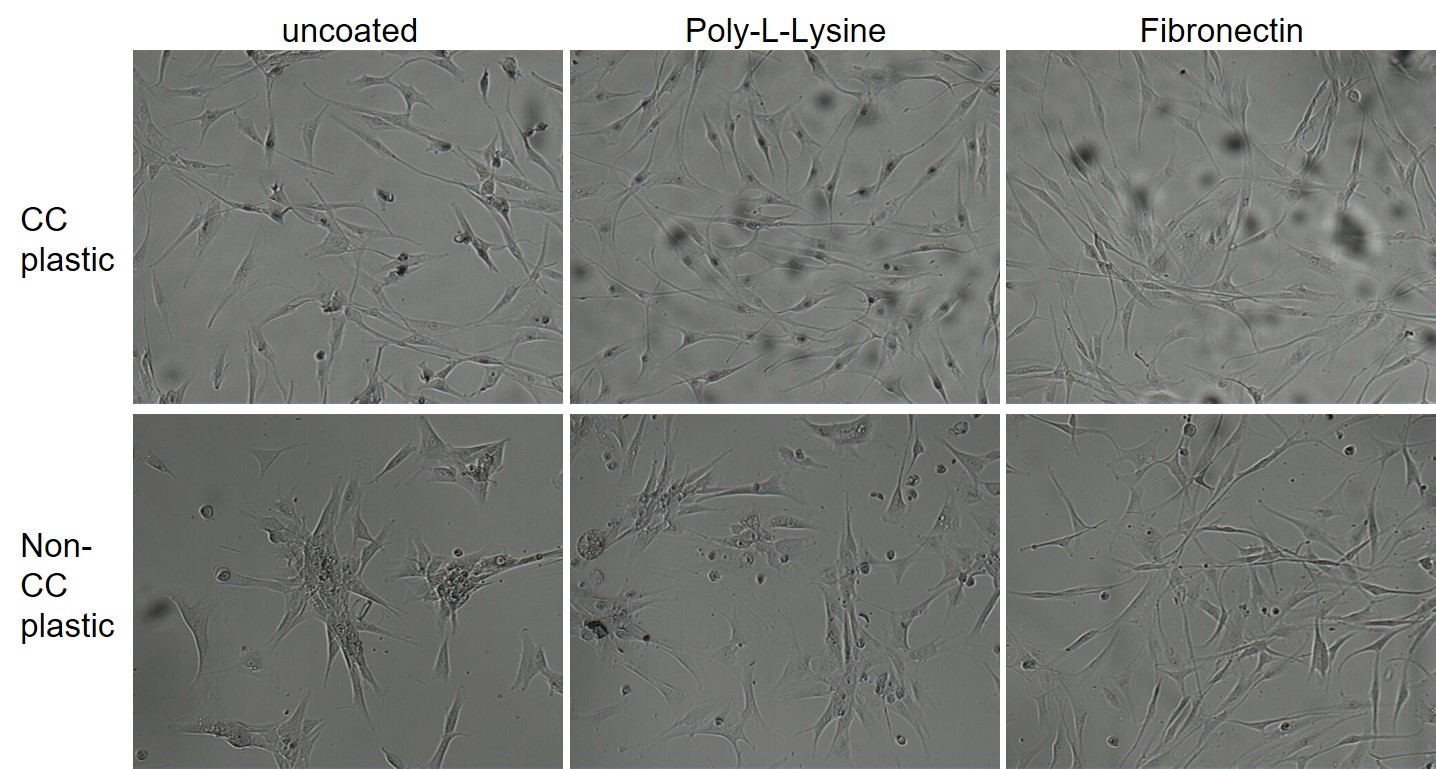
Die nachfolgende Grafik zeigt, dass im unter normalem Kulturbedingungen, also mit FCS im Medium, humane Fibroblasten mit normalen Oberflächen von ungecoatet über PLL-gecoated bis bin zu Fibronektin-beschichtet sehr gut klarkommen. Nur auf nicht behandeltem Plastik (ähnlich Bakterienschalen) zeigt sich der Effekt der Coatings. Für diese primären Zellen wäre also für die normale Kultur kein Coating nötig.
|
© InCelligence aus Kurs Bioassays |
PLL-Beschichtung von 96-well Platten als Schutz vor HEK 293 Zellverlust im Bioassay
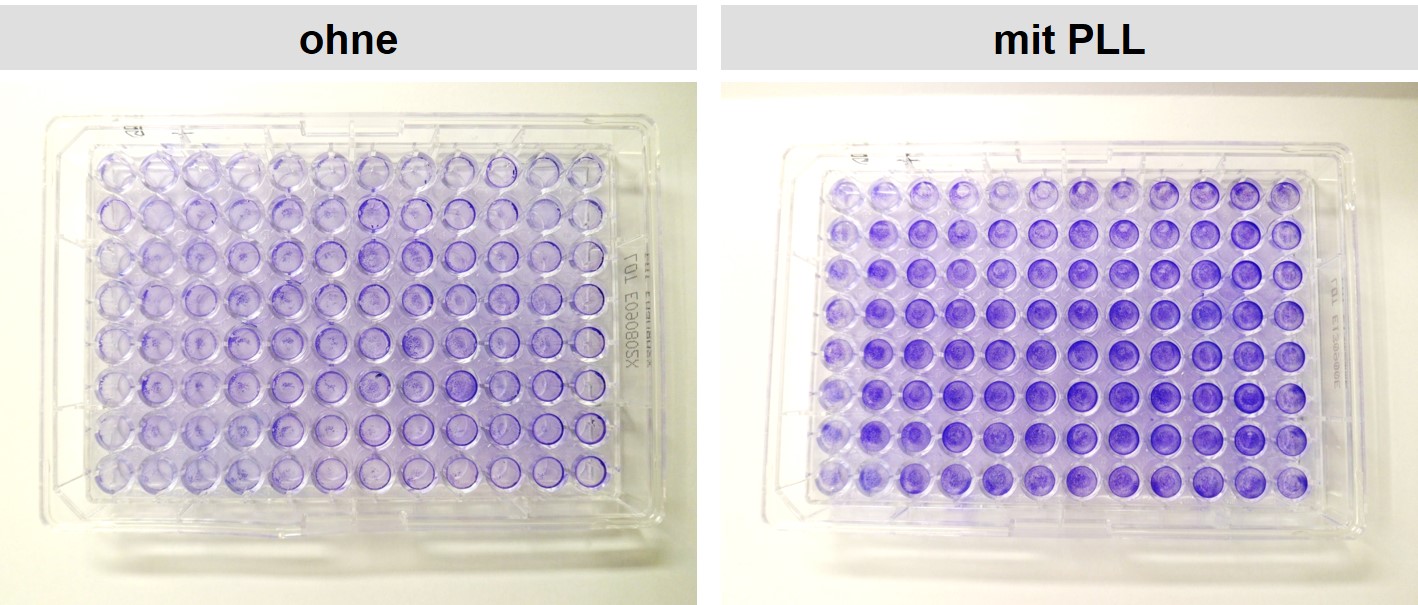
In aufwendigen Bioassays mit vielen Waschschritten kommt es oft vor, dass Teile der Zellen oder fast alle Zellen im Verlauf einer Färbung oder eines ELISA abgewaschen werden. Dies erhöht die Standardabweichung erheblich oder führt sogar dazu, dass ein Assay gar nicht mehr auswertbar ist. Um dies zu vermeiden kann man bei allen Zellen vor allem aber bei schlecht haftenden wie HEK 293 oder OLN 93 die Oberflächen der Multiwellplatten mit z.B. PLL beschichten. Hierdurch wird mind. ein Großteile des Abspülens vermieden oder mit der richtigen Technik und bei der richtigen Zellzahl das Abspülen sogar komplett vermieden. In der nachfolgenden Abbildung sieht man den Effekt zahlreicher Waschschritte auf HEK-Zellen in einem Kristallviolett-Assay für den identische Zellzahlen auf Platten mit und ohne PLL-Coating ausgesät wurden. Der protektive Effekt ist überall deutlich sichtbar an der intensiveren Farbe außer in der ersten Reihe (jeweils links). Die Bilder stammen aus einem Zellkultur-Consulting beim Kunden. Ähnliche Themen werden im Zellkultur Bioassay-Kurs behandelt.
|
© InCelligence aus Kurs Bioassays |
Extrazelluläre Matrix als Richtungsweiser für die Differenzierung
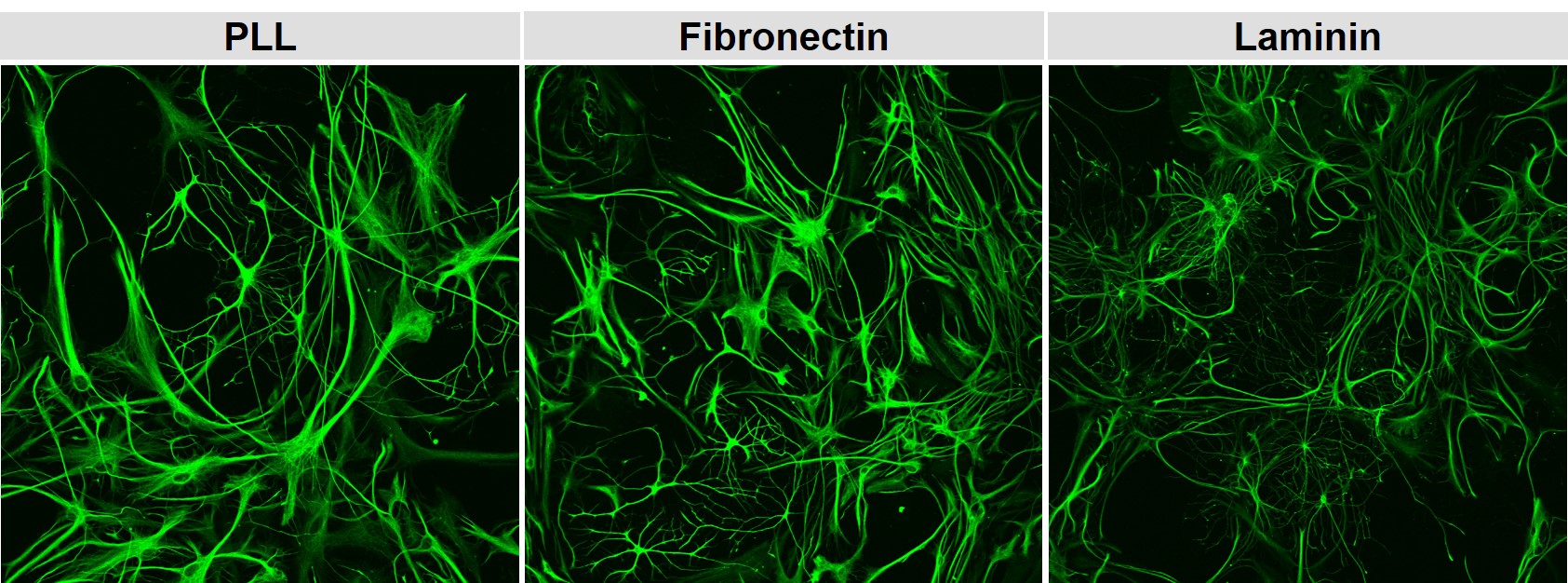
Für bestimmte Zelltypen ist die extrazelluläre Matrix auch eine Orientierungshilfe in welcher Umgebung, wo im Gewebe oder neben welchen anderen Zelltypen sie sitzen. Diese Signale werden über die Integrinbindung in intrazelluläre Signale übersetzt und können dann die Proliferation, Migration oder die Differenzierung beeinflussen. In der nachfolgenden Abbildung sieht man gemischte Gila aus neonatalem Rattenhirn in einer GFAP-Färbung für Astrozyten auf drei verschiedenen Oberflächen.
|
© InCelligence aus Zellkultur-Basis-Kurs |
Marktübersicht Coatings
Nachfolgend sieht man in der Tabelle eine aktuelle Marktübersicht der verschiedenen Beschichtungen die momentan angeboten werden.
|
|
Ease of use (protocol free) |
Adhesion Ligand |
Oligo-saccharide |
Degradable |
Cell recovery/ Trypsination |
Chemical reaction free |
Growth Factor storage/ |
Chemically-defined |
Microscopy compatible |
Suitable for Stem cell culture |
Suitable for Cancer cell culture |
Suitable for Primary cell culture |
Suitable for screening |
|
|
Fibronectin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
||||||
|
Vitronectin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
|||||
|
Osteopontin |
▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
||||||||
|
Collagen (I,IV,etc) |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
|||||
|
Gelatin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
|||||||
|
Laminin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
||||||
|
Biolamina, recombinant Laminin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
|||
|
3D MATRIX, puramatrix |
▪ | ▪ | ▪ | ▪ | ▪ |
Peptide nanofiber hydrogel |
||||||||
|
Pbiogelx, biogelx powder |
▪ | ▪ | ▪ | ▪ | ▪ |
Peptide nanofiber hydrogel |
||||||||
|
ESI-BIO, Hystem |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Hyaluronate, collagen, Polyethylene glycol |
||||||
|
Trevigen, cultrex |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
EHS tumor extract |
||||||
|
East River BioSolutions, TissueSpec |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Tissue-specific extracts |
||||||
|
Ectica, 3DProSeed |
▪ | ▪ | ▪ | ▪ | ▪ |
Polymer |
||||||||
|
Corning, matrigel |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
EHS tumor extract |
||||||
|
Corning, Synthemax |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Vitronectin-derived peptide |
|||
|
Corning, Synthemax II |
▪ | ▪ | ▪ | ▪ |
Plastic microbeads coated with synthemax |
|||||||||
|
Corning, Osteo-assay |
▪ | ▪ | ▪ | ▪ | ▪ |
Crystalline calcium phosphate |
||||||||
|
Corning, Ultra-low attachment |
▪ | ▪ | ▪ | ▪ |
Hydrophilic uncharged polymer surface |
|||||||||
|
BRTI Life Sciences, Cell-Mate3D |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Hyaluronate -Chitosan hydrogel |
||||||
|
Pepgel, PGmatrix |
▪ | ▪ | ▪ | ▪ | ▪ |
Peptide hydrogel |
||||||||
|
Novamatrix, Novatach |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
RGD coupled alginate |
|||||||
|
Orla, OrlaExplorer-ECM |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
32 recombinant ECM proteins |
||||
|
Cellendes, 3D-Life |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Dextran PVA - PEG hydrogels |
|||||||
|
Amsbio, mimetix |
▪ | ▪ | ▪ | ▪ | ▪ |
PLLA electrospun fibres |
||||||||
|
Amsbio, iMatrix |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
E8 Fragment from laminin |
||||
|
Amsbio, MAPTrix |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Recombinant chimeric ECM proteins |
||||
|
Amsbio, Alvetex |
▪ | ▪ | ▪ |
Porous Polystyrene sheet |
||||||||||
|
Noviocell, PIC hydrogel |
▪ | ▪ | ▪ | ▪ | ▪ |
Thermoreversible polyisocyanopeptide hydrogel |
||||||||
|
Organogenix, NanoCulture Plate |
▪ | ▪ | ▪ | ▪ |
Low adhesion patterned plates |
|||||||||
|
Primorigen biosciences, StemAdhere |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Recombinant protein, human origin |
||||||
|
The well bioscience, Vitrogel 3D |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Polysaccharide hydrogel, non-covalent crosslink |
|||||||
|
Thermofisher, Algimatrix |
▪ | ▪ | ▪ | ▪ | ▪ |
Alginate gels |
||||||||
|
Thermofisher, CELLstart |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Human plasma extract |
|||||
|
Thermofisher, Geltrex |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
EHS tumor extract |
|||||
|
Lonza, RAFT |
▪ | ▪ | ▪ | ▪ | ▪ |
Collagen, RAFT (Real Architecture For 3D Tissue) |
||||||||
|
Global Cell Solutions, GEM |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Alginate microcarrier ferromagnetic beads |
|||||||
|
InSphero, GravityPLUS |
▪ | ▪ | ▪ |
Hanging drop ECM-free |
||||||||||
|
DenovoMATRIX, screenMATRIX |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Glycosaminoglycan PEG-Peptide biomatrix |
Coating (Beschichtungen) für Zellkultur-Plastik
Als Coating oder Beschichtung von Zellkulturplastik bezeichnet man alle Oberflächenmodifikationen zur Adhäsion, die über die Corona- oder Plasmabehandlung beim Hersteller hinausgehen. Beide Begriffe werden synonym benutzt.
Typen von Beschichtungen in der Zellkultur
Wie hier beschrieben, besteht praktisch jedes Zellkultur-Plastik aus Polystyrol und wird von jeweiligen Hersteller zur Verbesserung der Zellanheftung oberflächenbehandelt. Trotz allem ist diese Oberfläche jedoch keine annähernd natürliche Oberfläche wie Zellen sie im Gewebe vorfinden können. D.h. die Komplexität des Zellkulturmodels in Bezug auf die Adhäsionsoberfläche kann von einfach bis histotypisch (gewebeähnlich) reichen:
- Unbehandeltes Polystyrol (Bakterienschalen), hydrophob und nur für wenige Zelltypen anwendbar (z.B. Schilddrüsenzellen, Keratinozyten)
- Oberflächenbehandeltes Polystyrol (normales Zellkulturplastik), polar und/oder geladen je nach Hersteller
- Einfache, künstliche, kostengünstige Beschichtung
x Poly-L-Lysin, Poly-D-Lysin
x Poly-Ornithin - Einfache, kostengünstige, unspezifisch proteinäre Beschichtung
x Gelatine - Spezifische extrazelluläre Matrixbeschichtung mit einem Protein (teurer, meist Isolate aus tierischem Gewebe))
x Collagen I, IV
x Fibronektin
x Laminin
x Vitronektin
x Osteopontin - Spezifische Teilsequenzen extrazellulärer Matrixproteine (teilweise noch teurer, teilweise GMP-konform, da synthetisch hergestellt)
x RGD-Motive
x Fibronektin-Domänen - Spezifische, komplexe Matrixbeschichtung
x Matrigel (mehrere Komponenten der extrazellulären Matrix mit gebundenen Wachstumsfaktoren etc.) - 3D Modelle in denen die Zellen in eine Matrix oder ein Gel eingebettet sind, u.a.
x Collagengele
x Matrigele
x Alginatgele
x Lactatgele


Warum verwendet man Coatings ?
Beschichtungen sind aufwendiger und teurer als die Kultur in normalen Zellkulturgefäßen. Für die meisten Grundlagenexperimente mit Zelllinien ist eine künstliche Oberfläche ausreichend, jedoch gibt es verschiedene Gründe aus denen man auf aufwendigere beschichtete oder gecoatete Oberflächen wechselt:
- Ohne Beschichtung haften die Zellen nicht oder sehr schlecht (Primäre Neurone, Oligodendrozyten, Hepatocyten)
- Die Beschichtung verhindert das Abwaschen der Zellen im Assay (HEK293, OLN93, HepG2)
- Die Beschichtung trägt zur Differenzierung der Zellen bei (Neurone, Glia, Keratinocyten, Hepatocyten)
- Ohne Beschichtung werden die Zellen seneszent oder dedifferenzieren (MSC, Hepatocyten)
- Die Zellen bilden auf der Beschichtung eine komplexere Morphologie (Glia, Neuronen, Hepatozyten, HepG2, Keratinozyten)
- Die Zellen polarisieren nur auf der Beschichtung (Schilddrüsenzellen, Hepatocyten, Keratinocyten)
- Es wird mit serumfreien Medien gearbeitet und die Zellen können ohne Beschichtung nicht überleben, proliferieren oder adhärieren (s.u.) (MSC, Stammzellen)
- Die Fragestellung ist sehr spezifisch und kann nur in einem echten 3D-Model beantwortet werden (Hautmodelle, Sphäroide, Angiogenese, Knochen, Knorpel)
Generell wachsen alle Zellen lieber und meist auch besser auf einer beschichteten als unbeschichteten Oberfläche. D.h. der Experimentator entscheidet je nach Fragestellung und Notwendigkeit. Für anspruchslose Zelllinien besteht nicht die Notwendigkeit zur Beschichtung daher nutzt man ungecoatetes Plastik. Bei anspruchsvolleren Linien und speziell Primärzellen dagegen ist oft eine Beschichtung für die normale Zellkultur hilfreich und manchmal sogar unabdingbar ist. Je "näher" außerdem die Umgebung der Zellen an der natürlichen Gewebesituation ist, umso übertragbarer sind dann natürlich auch die Ergebnisse.
Anwendungsbeispiele für Beschichtungen
Serumfreie oder xenofreie Zellkultur von MSCs (mesenchymalen Stammzellen)
In den nachfolgenden Abbildung von denovoMATRIX sieht man wie für die Kultur von mesenchymalen Stammzellen (MSC) mit dem Wechsel von einem FCS- oder serumhaltigen Medium zu einem serumfreien oder Xeno-freien Medium die Notwendigkeit eines Coatings entsteht. Die anspruchsvollen MSC können nicht an das Zellkulturplastik anheften, wenn ihnen Serumproteine fehlen, die dies ermöglichen. Dies wird durch die Beschichtung ausgeglichen.
|
© denovoMATRIX modified by InCelligence |
Kultur von humanen Fibroblasten auf verschiedenen Oberflächen mit FCS-haltigem Medium
Die nachfolgende Grafik zeigt, dass im unter normalem Kulturbedingungen, also mit FCS im Medium, humane Fibroblasten mit normalen Oberflächen von ungecoatet über PLL-gecoated bis bin zu Fibronektin-beschichtet sehr gut klarkommen. Nur auf nicht behandeltem Plastik (ähnlich Bakterienschalen) zeigt sich der Effekt der Coatings. Für diese primären Zellen wäre also für die normale Kultur kein Coating nötig.
|
© InCelligence aus Kurs Bioassays |
PLL-Beschichtung von 96-well Platten als Schutz vor HEK 293 Zellverlust im Bioassay
In aufwendigen Bioassays mit vielen Waschschritten kommt es oft vor, dass Teile der Zellen oder fast alle Zellen im Verlauf einer Färbung oder eines ELISA abgewaschen werden. Dies erhöht die Standardabweichung erheblich oder führt sogar dazu, dass ein Assay gar nicht mehr auswertbar ist. Um dies zu vermeiden kann man bei allen Zellen vor allem aber bei schlecht haftenden wie HEK 293 oder OLN 93 die Oberflächen der Multiwellplatten mit z.B. PLL beschichten. Hierdurch wird mind. ein Großteile des Abspülens vermieden oder mit der richtigen Technik und bei der richtigen Zellzahl das Abspülen sogar komplett vermieden. In der nachfolgenden Abbildung sieht man den Effekt zahlreicher Waschschritte auf HEK-Zellen in einem Kristallviolett-Assay für den identische Zellzahlen auf Platten mit und ohne PLL-Coating ausgesät wurden. Der protektive Effekt ist überall deutlich sichtbar an der intensiveren Farbe außer in der ersten Reihe (jeweils links). Die Bilder stammen aus einem Zellkultur-Consulting beim Kunden. Ähnliche Themen werden im Zellkultur Bioassay-Kurs behandelt.
|
© InCelligence aus Kurs Bioassays |
Extrazelluläre Matrix als Richtungsweiser für die Differenzierung
Für bestimmte Zelltypen ist die extrazelluläre Matrix auch eine Orientierungshilfe in welcher Umgebung, wo im Gewebe oder neben welchen anderen Zelltypen sie sitzen. Diese Signale werden über die Integrinbindung in intrazelluläre Signale übersetzt und können dann die Proliferation, Migration oder die Differenzierung beeinflussen. In der nachfolgenden Abbildung sieht man gemischte Gila aus neonatalem Rattenhirn in einer GFAP-Färbung für Astrozyten auf drei verschiedenen Oberflächen.
|
© InCelligence aus Zellkultur-Basis-Kurs |
Marktübersicht Coatings
Nachfolgend sieht man in der Tabelle eine aktuelle Marktübersicht der verschiedenen Beschichtungen die momentan angeboten werden.
|
|
Ease of use (protocol free) |
Adhesion Ligand |
Oligo-saccharide |
Degradable |
Cell recovery/ Trypsination |
Chemical reaction free |
Growth Factor storage/ |
Chemically-defined |
Microscopy compatible |
Suitable for Stem cell culture |
Suitable for Cancer cell culture |
Suitable for Primary cell culture |
Suitable for screening |
|
|
Fibronectin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
||||||
|
Vitronectin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
|||||
|
Osteopontin |
▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
||||||||
|
Collagen (I,IV,etc) |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
|||||
|
Gelatin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
|||||||
|
Laminin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
||||||
|
Biolamina, recombinant Laminin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
|||
|
3D MATRIX, puramatrix |
▪ | ▪ | ▪ | ▪ | ▪ |
Peptide nanofiber hydrogel |
||||||||
|
Pbiogelx, biogelx powder |
▪ | ▪ | ▪ | ▪ | ▪ |
Peptide nanofiber hydrogel |
||||||||
|
ESI-BIO, Hystem |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Hyaluronate, collagen, Polyethylene glycol |
||||||
|
Trevigen, cultrex |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
EHS tumor extract |
||||||
|
East River BioSolutions, TissueSpec |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Tissue-specific extracts |
||||||
|
Ectica, 3DProSeed |
▪ | ▪ | ▪ | ▪ | ▪ |
Polymer |
||||||||
|
Corning, matrigel |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
EHS tumor extract |
||||||
|
Corning, Synthemax |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Vitronectin-derived peptide |
|||
|
Corning, Synthemax II |
▪ | ▪ | ▪ | ▪ |
Plastic microbeads coated with synthemax |
|||||||||
|
Corning, Osteo-assay |
▪ | ▪ | ▪ | ▪ | ▪ |
Crystalline calcium phosphate |
||||||||
|
Corning, Ultra-low attachment |
▪ | ▪ | ▪ | ▪ |
Hydrophilic uncharged polymer surface |
|||||||||
|
BRTI Life Sciences, Cell-Mate3D |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Hyaluronate -Chitosan hydrogel |
||||||
|
Pepgel, PGmatrix |
▪ | ▪ | ▪ | ▪ | ▪ |
Peptide hydrogel |
||||||||
|
Novamatrix, Novatach |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
RGD coupled alginate |
|||||||
|
Orla, OrlaExplorer-ECM |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
32 recombinant ECM proteins |
||||
|
Cellendes, 3D-Life |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Dextran PVA - PEG hydrogels |
|||||||
|
Amsbio, mimetix |
▪ | ▪ | ▪ | ▪ | ▪ |
PLLA electrospun fibres |
||||||||
|
Amsbio, iMatrix |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
E8 Fragment from laminin |
||||
|
Amsbio, MAPTrix |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Recombinant chimeric ECM proteins |
||||
|
Amsbio, Alvetex |
▪ | ▪ | ▪ |
Porous Polystyrene sheet |
||||||||||
|
Noviocell, PIC hydrogel |
▪ | ▪ | ▪ | ▪ | ▪ |
Thermoreversible polyisocyanopeptide hydrogel |
||||||||
|
Organogenix, NanoCulture Plate |
▪ | ▪ | ▪ | ▪ |
Low adhesion patterned plates |
|||||||||
|
Primorigen biosciences, StemAdhere |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Recombinant protein, human origin |
||||||
|
The well bioscience, Vitrogel 3D |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Polysaccharide hydrogel, non-covalent crosslink |
|||||||
|
Thermofisher, Algimatrix |
▪ | ▪ | ▪ | ▪ | ▪ |
Alginate gels |
||||||||
|
Thermofisher, CELLstart |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Human plasma extract |
|||||
|
Thermofisher, Geltrex |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
EHS tumor extract |
|||||
|
Lonza, RAFT |
▪ | ▪ | ▪ | ▪ | ▪ |
Collagen, RAFT (Real Architecture For 3D Tissue) |
||||||||
|
Global Cell Solutions, GEM |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Alginate microcarrier ferromagnetic beads |
|||||||
|
InSphero, GravityPLUS |
▪ | ▪ | ▪ |
Hanging drop ECM-free |
||||||||||
|
DenovoMATRIX, screenMATRIX |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Glycosaminoglycan PEG-Peptide biomatrix |
Mikroskope für die Zellkultur (außerhalb und im Inkubator)
Zellen mikroskopisch zu kontrollieren ist eines der wichtigsten Werkzeuge der Zellkultur. Erstens kann man mikroskopisch viele Kontaminationen (Bakterien, Hefen, Pilze) und Kreuzkontaminationen erkennen, zweitens lässt sich über die Konfluenz (Grad der Bewachsung der Flaschen oder Schalen in %) die Notwendigkeit des Splittens (Passagierens) prüfen und drittens erkennt man mit etwas Übung an den eigenen Zellen auch über die Morphologie, ob es den Zellen gut geht oder etwas "nicht stimmt". Bei Primärzellen kann man darüber hinaus auch morphologisch kontrollieren, ob man den richtigen Zelltyp in Kultur hat oder eine hohe Rate an Fremdzellen.
Mikroskope für die Routinekontrolle in der Zellkultur
|
Prinzipiell kommen für die Routinekontrolle in der Zellkultur zwei Arten von Mikroskopen in Frage:
|
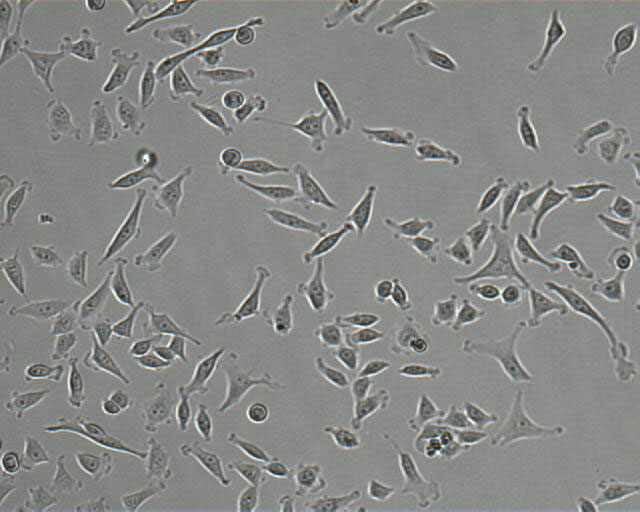 |
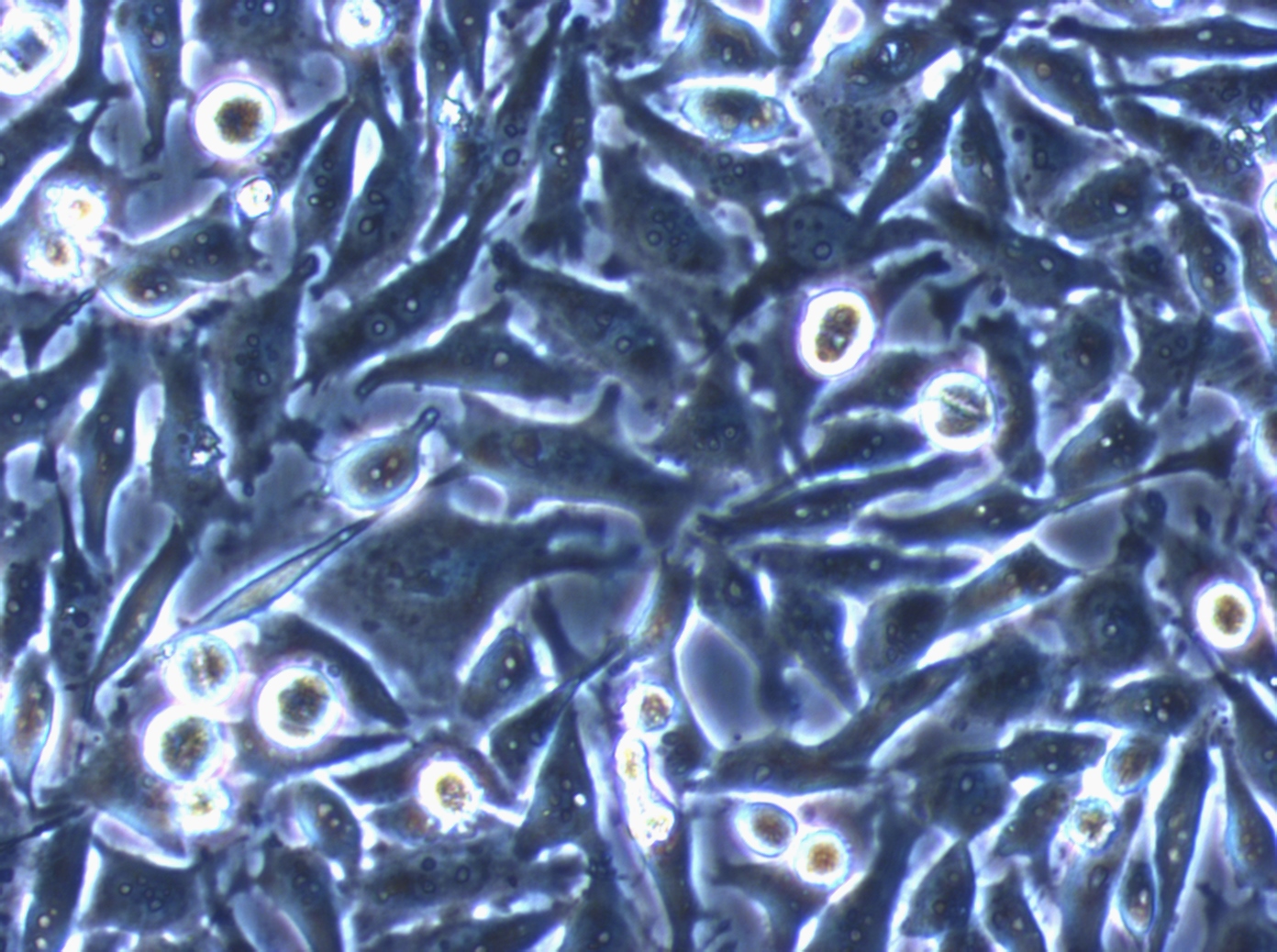 |
Phasenkontrast-Mikroskope sind deutlich teurer und verfügen nicht über cools gadgets wie Touch screen und Freihandzoom, aber wenn man die Bilder direkt vergleicht, sieht man, dass man im Phasenkontrast viel mehr Details erkennen kann und nur so kann man auch alle wichtigen Informationen "herauslesen". Unserer Meinung nach ist es unabdingbar, dass jeden Labor, egal wie viel oder wenig Geld zur Verfügung steht, ein Phasenkontrastmikrosop besitzt. Nur so lassen sich alle Qualitätskontrollen sinnvoll durchführen. Zusätzlich sollte auch jedes Labor eine ans Mikroskop angeschlossene Kamera haben, um diese Kriterien über die Bilder zu dokumentieren.
Die Dokumentation der Morphologie ist unter GMP sowohl für die Produktion als auch die Qualitätskontrolle vorgeschrieben.
Mikroskope die im Inkubator stehen (real-time Mikroskopie, online monitoring)
In den letzten Jahren sind immer mehr Mikroskope auf den Markt gekommen, die eine ganz neue Funktion erfüllen, nämlich Zellen zu monitoren oder experimentell auszuwerten. Solche Mikroskope können grundlegend zwei verschiedene Dinge:
- Fluoreszenzmikroskope zeichnen die Expression und evtl. Verteilung von Fluoreszenz-gekoppelten Proteinen auf (Fotos, Filme)
- Hellfeldmikroskope messen die Verteilung und Dichte der Zellen in einer Platte oder Flasche (Fotos und Kurvenauswertung)
Während erstere also fast reine Assaysanwendung finden, können letztere sowohl im Assay als auch auch zur Routinekontrolle verwendet werden. Gerade für Herstellungslabore (GMP, ATMP, TEMP) ist es sehr aufwendig einzuschleusen, um die Zellen zu kontrollieren. Hier ist es sehr nützlich, die Zellen online prüfen zu können und nur dann einzuschleusen, wenn die Zellen auch bearbeitet werden müssen. Außerdem kann man auf die Art tatsächlich in real-time die Wachstumsänderungen an stark variablen autologen Zellen wie Stammzellen (z.B. MSC) monitoren und dokumentieren.
InnoMe - zenCELL owl - 24-well Inkubatormikroskop - Live cell imaging im Inkubator
Das zenCELL owl ist ein kleines, handliches Mikroskop, das im Inkubator steht. Es wird für 24-well Platten verwendet und hat für jedes well eine Kamera, die regelmäßig Fotos der Zellen macht. Die Fotos können einzeln oder als Film ausgegeben werden. Ein wichtiger Einsatzbereich sind z.B. Scratch- oder Migrationsassays auf Ibidi-Platten. In den Hellfeld-Aufnahmen können von der Software automatisch Zellen erkannt werden und über die Fläche oder Konfluenz wird dann der Verschluss der Scratches in Wundheilungs-Assays verfolgt und ausgewertet.
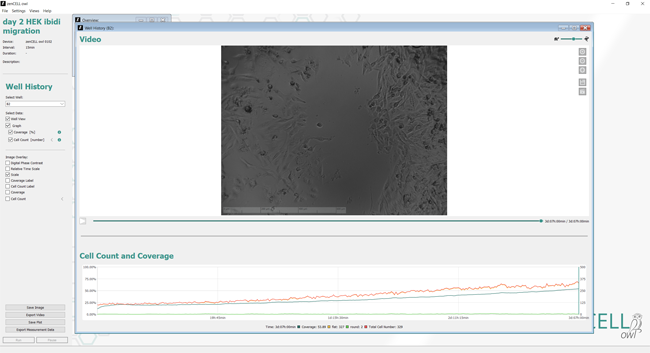
 |
||
|
Produktionsorte |
Deutschland |
|
|
QMS |
||
|
Gehäuse Material |
Kunststoff |
|
|
Stromversorgung |
5V |
|
|
Interface (Stromzufuhr/Datentransfer) |
USB 3.0 |
|
|
Schutzklasse |
IP62 |
|
|
Anwendungsumfeld |
20-45°C 20-95% Feuchtigkeit |
|
|
Säuberung |
Desinfektion mit Isopropanol, Ethanol |
|
|
Größe (BxHxT) in mm |
105 x 180 x 180 |
|
|
Gewicht in g |
1050 |
|
|
Lichtquelle |
44 x LEDs |
|
|
Kamera |
24 x 5MP CMOS Sensoren |
|
|
Optische Filter |
Keine |
|
|
Kontrastmethoden |
Digitaler Phasenkontrast |
|
|
FOV pro Kamera |
1,2mm x 0,9mm |
|
|
Auflösung pro Kamera |
2588 x 1944 |
|
|
Bildauflösung |
5 MP |
|
|
Vergrößerung |
10X (Digitaler Zoom) |
|
|
Bilderfassungszeit |
ca. 20 Sekunden für 24 Bilder |
|
|
Interval |
5min – 24h |
|
|
Exportformat |
Bilder: JPG, PNG Plots/Graphen: BMP Datensatz: CSV |
|
|
Anwendungsbereiche |
Zellkulturüberwachung/Live Cell Imaging für: Proliferation Assays Scratch/Wound Healing/Migration Assays Confluency Assays Compound/Cytotox Assays IVF Spehroide/Organoide QC/Automatisierung |
|
|
Bekannte Vorteile |
|
|
|
Bekannte Nachteile |
|
|
|
Weitere Informationen |
Hier können sie alles vermerken, was sie oben nicht untergebracht haben. Dieser Text wird von uns geprüft und gegebenenfalls angepasst. Er muss also nicht komplett sauber ausformuliert sein. |
|
|
Webseite |
Jobs und Stellenausschreibungen unserer Kunden
Folgende Stellen sind bei unseren Beratungskunden gerade zu besetzen:
Stellenausschreibung: Offenbach
Wissenschaftliche und persönliche Projektassistenz der Klinikleitung
Für unsere renommierte radiologische Klinik in Offenbach suchen wir zum nächstmöglichen Zeitpunkt eine/n persönliche Assistentin oder Assistenten des Klinikleiters. Das Institut für bildgebende Diagnostik ist eine große Praxisklinik, in der, neben herkömmlicher radiologischer Diagnostik (CT, MRT), auch innovative neue Behandlungsmethoden der Tumortherapie zur Anwendung kommen. Darüber hinaus befindet sich ein neuer Teilbereich, das Institut für regenerative Medizin, im Aufbau.
Ihre Aufgabengebiete umfassen ein weites, anforderungsreiches Gebiet an anfallen Arbeiten. Sie sind die kommunikative Schnittstelle zwischen dem Klinikleiter und allen anderen Abteilungen und somit im Spannungsfeld zwischen Klinikroutine und innovativer Methodik. Sie koordinieren die Kommunikation und prüfen die Umsetzung von Projekten. Sie bereiten wissenschaftliche Vorträge vor und werten klinische Daten für Veröffentlichungen aus. Sie nehmen an Qualitätssitzungen aller Abteilungen teil, dokumentieren Projektfortschritte und berichten täglich direkt an den Klinikleiter. Sie planen und koordinieren Reisen oder nehmen auch selbst an projektbezogenen Reisen teil.
Repräsentatives Auftreten und sichere Kommunikation auch auf Englisch sind in unserem internationalen Umfeld eine Grundvoraussetzung. Ein naturwissenschaftlicher, biomedizinischer oder physikalischer Hintergrund ist die Grundlage für ihre wissenschaftliche Assistenz. 10 Jahre Berufserfahrung in einem oder mehreren relevanten Feldern bilden die Basis für ihre konstruktive Rolle in der Strukturierung eines dynamischen und schnell wachsenden Umfelds. Eine gefestigte Persönlichkeit erlaubt ihnen eine vermittelnde Rolle auch in schwierigen Situationen einzunehmen. Optimalerweise haben sie Erfahrung und Interesse an Qualitätsmanagement.
Sie suchen eine multidimensionale Herausforderung und sind vielseitig interessiert? Sie sind flexibel und teamfähig? Sie sind strukturiert und kreativ? Sie können Verantwortung tragen und abgeben? Dann senden sie ihre aussagekräftige Bewerbung an