Coating (Beschichtungen) für Zellkultur-Plastik
Als Coating oder Beschichtung von Zellkulturplastik bezeichnet man alle Oberflächenmodifikationen zur Adhäsion, die über die Corona- oder Plasmabehandlung beim Hersteller hinausgehen. Beide Begriffe werden synonym benutzt.
Typen von Beschichtungen in der Zellkultur
Wie hier beschrieben, besteht praktisch jedes Zellkultur-Plastik aus Polystyrol und wird von jeweiligen Hersteller zur Verbesserung der Zellanheftung oberflächenbehandelt. Trotz allem ist diese Oberfläche jedoch keine annähernd natürliche Oberfläche wie Zellen sie im Gewebe vorfinden können. D.h. die Komplexität des Zellkulturmodels in Bezug auf die Adhäsionsoberfläche kann von einfach bis histotypisch (gewebeähnlich) reichen:
- Unbehandeltes Polystyrol (Bakterienschalen), hydrophob und nur für wenige Zelltypen anwendbar (z.B. Schilddrüsenzellen, Keratinozyten)
- Oberflächenbehandeltes Polystyrol (normales Zellkulturplastik), polar und/oder geladen je nach Hersteller
- Einfache, künstliche, kostengünstige Beschichtung
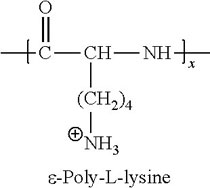
x Poly-L-Lysin, Poly-D-Lysin
x Poly-Ornithin - Einfache, kostengünstige, unspezifisch proteinäre Beschichtung
x Gelatine - Spezifische extrazelluläre Matrixbeschichtung mit einem Protein (teurer,
meist Isolate aus tierischem Gewebe))
x Collagen I, IV
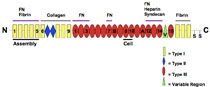
x Fibronektin
x Laminin
x Vitronektin
x Osteopontin - Spezifische Teilsequenzen extrazellulärer Matrixproteine (teilweise noch
teurer, teilweise GMP-konform, da synthetisch hergestellt)
x RGD-Motive
x Fibronektin-Domänen - Spezifische, komplexe Matrixbeschichtung
x Matrigel (mehrere Komponenten der extrazellulären Matrix mit gebundenen Wachstumsfaktoren etc.) - 3D Modelle in denen die Zellen in eine Matrix oder ein Gel eingebettet
sind, u.a.
x Collagengele
x Matrigele
x Alginatgele
x Lactatgele
Warum verwendet man Coatings ?
Beschichtungen sind aufwendiger und teurer als die Kultur in normalen Zellkulturgefäßen. Für die meisten Grundlagenexperimente mit Zelllinien ist eine künstliche Oberfläche ausreichend, jedoch gibt es verschiedene Gründe aus denen man auf aufwendigere beschichtete oder gecoatete Oberflächen wechselt:
- Ohne Beschichtung haften die Zellen nicht oder sehr schlecht (Primäre Neurone, Oligodendrozyten, Hepatocyten)
- Die Beschichtung verhindert das Abwaschen der Zellen im Assay (HEK293, OLN93, HepG2)
- Die Beschichtung trägt zur Differenzierung der Zellen bei (Neurone, Glia, Keratinocyten, Hepatocyten)
- Ohne Beschichtung werden die Zellen seneszent oder dedifferenzieren (MSC, Hepatocyten)
- Die Zellen bilden auf der Beschichtung eine komplexere Morphologie (Glia, Neuronen, Hepatozyten, HepG2, Keratinozyten)
- Die Zellen polarisieren nur auf der Beschichtung (Schilddrüsenzellen, Hepatocyten, Keratinocyten)
- Es wird mit serumfreien Medien gearbeitet und die Zellen können ohne Beschichtung nicht überleben, proliferieren oder adhärieren (s.u.) (MSC, Stammzellen)
- Die Fragestellung ist sehr spezifisch und kann nur in einem echten 3D-Model beantwortet werden (Hautmodelle, Sphäroide, Angiogenese, Knochen, Knorpel)
Generell wachsen alle Zellen lieber und meist auch besser auf einer beschichteten als unbeschichteten Oberfläche. D.h. der Experimentator entscheidet je nach Fragestellung und Notwendigkeit. Für anspruchslose Zelllinien besteht nicht die Notwendigkeit zur Beschichtung daher nutzt man ungecoatetes Plastik. Bei anspruchsvolleren Linien und speziell Primärzellen dagegen ist oft eine Beschichtung für die normale Zellkultur hilfreich und manchmal sogar unabdingbar ist. Je "näher" außerdem die Umgebung der Zellen an der natürlichen Gewebesituation ist, umso übertragbarer sind dann natürlich auch die Ergebnisse.
Anwendungsbeispiele für Beschichtungen
Serumfreie oder xenofreie Zellkultur von MSCs (mesenchymalen Stammzellen)
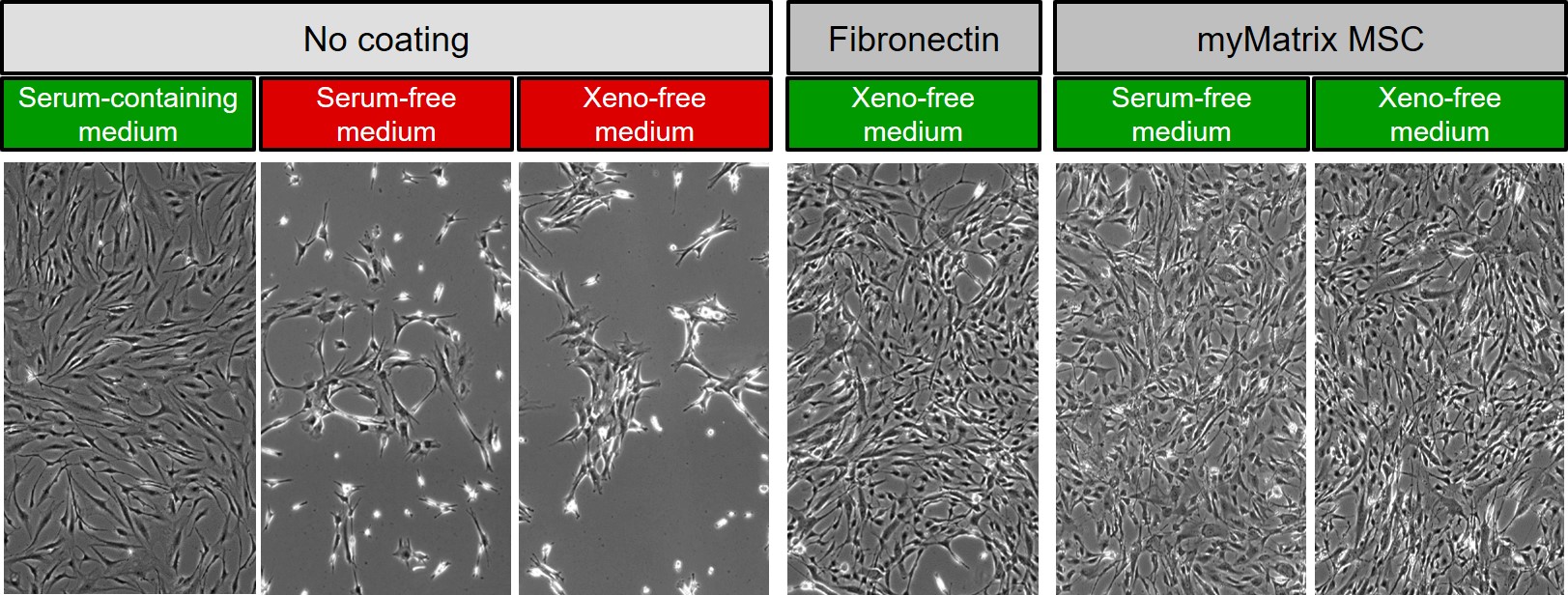
In den nachfolgenden Abbildung von denovoMATRIX sieht man wie für die Kultur von mesenchymalen Stammzellen (MSC) mit dem Wechsel von einem FCS- oder serumhaltigen Medium zu einem serumfreien oder Xeno-freien Medium die Notwendigkeit eines Coatings entsteht. Die anspruchsvollen MSC können nicht an das Zellkulturplastik anheften, wenn ihnen Serumproteine fehlen, die dies ermöglichen. Dies wird durch die Beschichtung ausgeglichen.
|
© denovoMATRIX modified by InCelligence |
Kultur von humanen Fibroblasten auf verschiedenen Oberflächen mit FCS-haltigem Medium
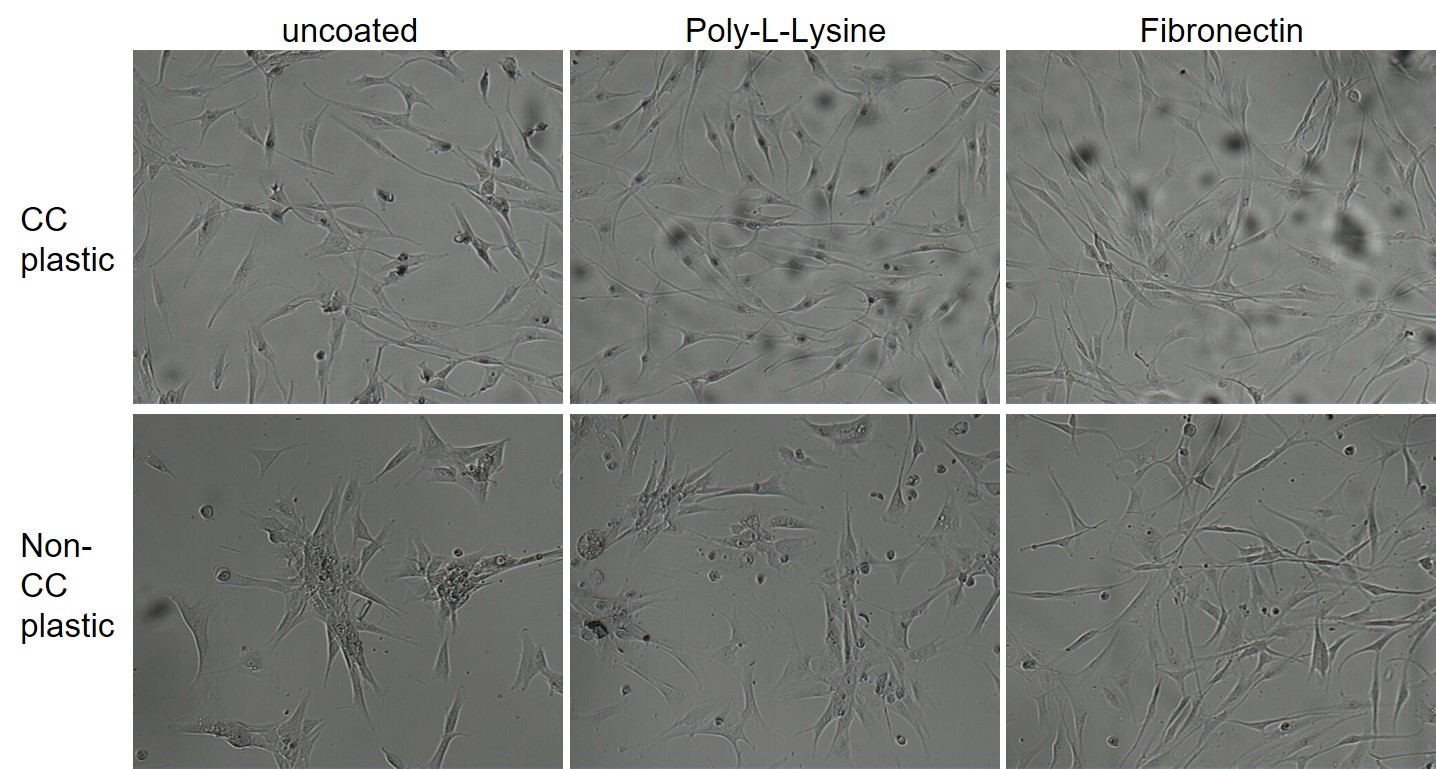
Die nachfolgende Grafik zeigt, dass im unter normalem Kulturbedingungen, also mit FCS im Medium, humane Fibroblasten mit normalen Oberflächen von ungecoatet über PLL-gecoated bis bin zu Fibronektin-beschichtet sehr gut klarkommen. Nur auf nicht behandeltem Plastik (ähnlich Bakterienschalen) zeigt sich der Effekt der Coatings. Für diese primären Zellen wäre also für die normale Kultur kein Coating nötig.
|
© InCelligence aus Kurs Bioassays |
PLL-Beschichtung von 96-well Platten als Schutz vor HEK 293 Zellverlust im Bioassay
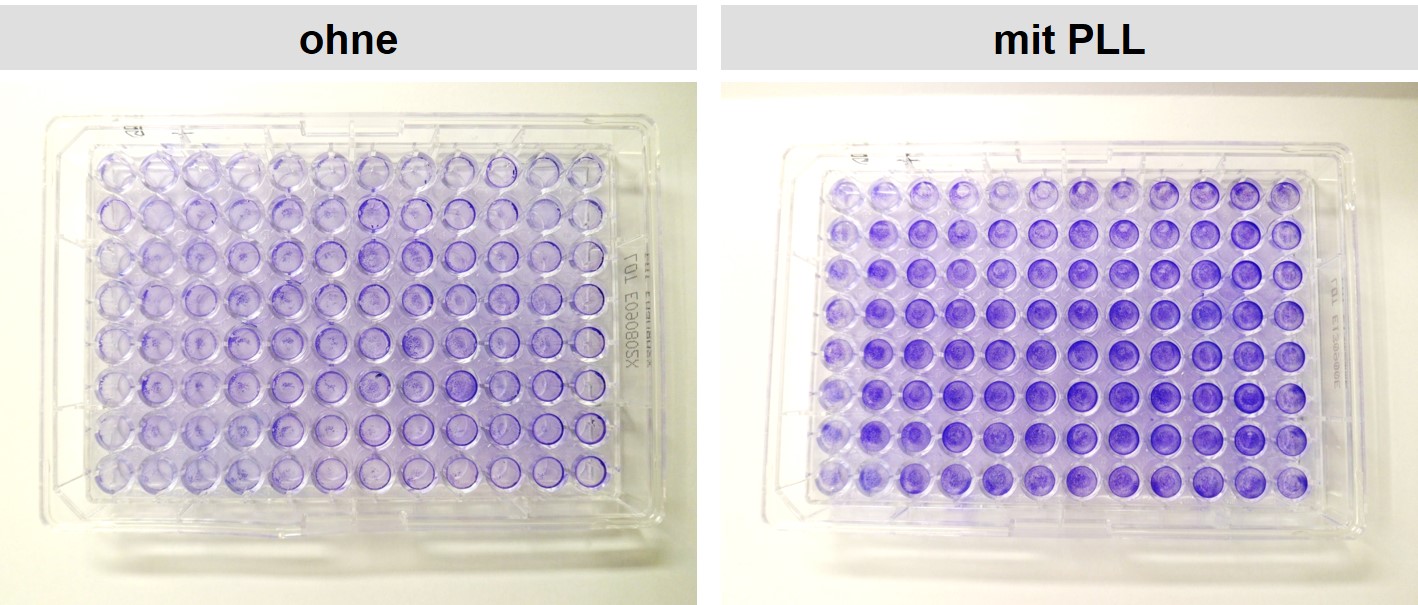
In aufwendigen Bioassays mit vielen Waschschritten kommt es oft vor, dass Teile der Zellen oder fast alle Zellen im Verlauf einer Färbung oder eines ELISA abgewaschen werden. Dies erhöht die Standardabweichung erheblich oder führt sogar dazu, dass ein Assay gar nicht mehr auswertbar ist. Um dies zu vermeiden kann man bei allen Zellen vor allem aber bei schlecht haftenden wie HEK 293 oder OLN 93 die Oberflächen der Multiwellplatten mit z.B. PLL beschichten. Hierdurch wird mind. ein Großteile des Abspülens vermieden oder mit der richtigen Technik und bei der richtigen Zellzahl das Abspülen sogar komplett vermieden. In der nachfolgenden Abbildung sieht man den Effekt zahlreicher Waschschritte auf HEK-Zellen in einem Kristallviolett-Assay für den identische Zellzahlen auf Platten mit und ohne PLL-Coating ausgesät wurden. Der protektive Effekt ist überall deutlich sichtbar an der intensiveren Farbe außer in der ersten Reihe (jeweils links). Die Bilder stammen aus einem Zellkultur-Consulting beim Kunden. Ähnliche Themen werden im Zellkultur Bioassay-Kurs behandelt.
|
© InCelligence aus Kurs Bioassays |
Extrazelluläre Matrix als Richtungsweiser für die Differenzierung
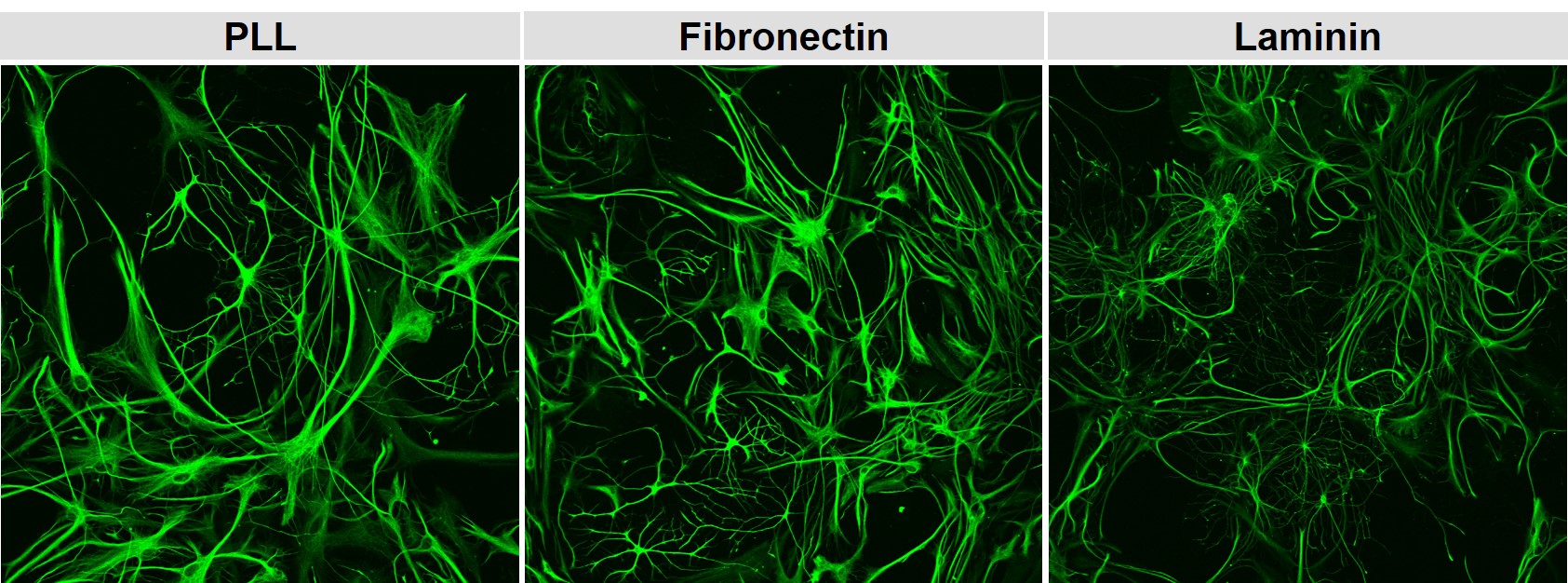
Für bestimmte Zelltypen ist die extrazelluläre Matrix auch eine Orientierungshilfe in welcher Umgebung, wo im Gewebe oder neben welchen anderen Zelltypen sie sitzen. Diese Signale werden über die Integrinbindung in intrazelluläre Signale übersetzt und können dann die Proliferation, Migration oder die Differenzierung beeinflussen. In der nachfolgenden Abbildung sieht man gemischte Gila aus neonatalem Rattenhirn in einer GFAP-Färbung für Astrozyten auf drei verschiedenen Oberflächen.
|
© InCelligence aus Zellkultur-Basis-Kurs |
Marktübersicht Coatings
Nachfolgend sieht man in der Tabelle eine aktuelle Marktübersicht der verschiedenen Beschichtungen die momentan angeboten werden.
|
|
Ease of use (protocol free) |
Adhesion Ligand |
Oligo-saccharide |
Degradable |
Cell recovery/ Trypsination |
Chemical reaction free |
Growth Factor storage/ |
Chemically-defined |
Microscopy compatible |
Suitable for Stem cell culture |
Suitable for Cancer cell culture |
Suitable for Primary cell culture |
Suitable for screening |
|
|
Fibronectin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
||||||
|
Vitronectin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
|||||
|
Osteopontin |
▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
||||||||
|
Collagen (I,IV,etc) |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
|||||
|
Gelatin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
|||||||
|
Laminin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
||||||
|
Biolamina, recombinant Laminin |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
ECM protein |
|||
|
3D MATRIX, puramatrix |
▪ | ▪ | ▪ | ▪ | ▪ |
Peptide nanofiber hydrogel |
||||||||
|
Pbiogelx, biogelx powder |
▪ | ▪ | ▪ | ▪ | ▪ |
Peptide nanofiber hydrogel |
||||||||
|
ESI-BIO, Hystem |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Hyaluronate, collagen, Polyethylene glycol |
||||||
|
Trevigen, cultrex |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
EHS tumor extract |
||||||
|
East River BioSolutions, TissueSpec |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Tissue-specific extracts |
||||||
|
Ectica, 3DProSeed |
▪ | ▪ | ▪ | ▪ | ▪ |
Polymer |
||||||||
|
Corning, matrigel |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
EHS tumor extract |
||||||
|
Corning, Synthemax |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Vitronectin-derived peptide |
|||
|
Corning, Synthemax II |
▪ | ▪ | ▪ | ▪ |
Plastic microbeads coated with synthemax |
|||||||||
|
Corning, Osteo-assay |
▪ | ▪ | ▪ | ▪ | ▪ |
Crystalline calcium phosphate |
||||||||
|
Corning, Ultra-low attachment |
▪ | ▪ | ▪ | ▪ |
Hydrophilic uncharged polymer surface |
|||||||||
|
BRTI Life Sciences, Cell-Mate3D |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Hyaluronate -Chitosan hydrogel |
||||||
|
Pepgel, PGmatrix |
▪ | ▪ | ▪ | ▪ | ▪ |
Peptide hydrogel |
||||||||
|
Novamatrix, Novatach |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
RGD coupled alginate |
|||||||
|
Orla, OrlaExplorer-ECM |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
32 recombinant ECM proteins |
||||
|
Cellendes, 3D-Life |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Dextran PVA - PEG hydrogels |
|||||||
|
Amsbio, mimetix |
▪ | ▪ | ▪ | ▪ | ▪ |
PLLA electrospun fibres |
||||||||
|
Amsbio, iMatrix |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
E8 Fragment from laminin |
||||
|
Amsbio, MAPTrix |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Recombinant chimeric ECM proteins |
||||
|
Amsbio, Alvetex |
▪ | ▪ | ▪ |
Porous Polystyrene sheet |
||||||||||
|
Noviocell, PIC hydrogel |
▪ | ▪ | ▪ | ▪ | ▪ |
Thermoreversible polyisocyanopeptide hydrogel |
||||||||
|
Organogenix, NanoCulture Plate |
▪ | ▪ | ▪ | ▪ |
Low adhesion patterned plates |
|||||||||
|
Primorigen biosciences, StemAdhere |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Recombinant protein, human origin |
||||||
|
The well bioscience, Vitrogel 3D |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Polysaccharide hydrogel, non-covalent crosslink |
|||||||
|
Thermofisher, Algimatrix |
▪ | ▪ | ▪ | ▪ | ▪ |
Alginate gels |
||||||||
|
Thermofisher, CELLstart |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Human plasma extract |
|||||
|
Thermofisher, Geltrex |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
EHS tumor extract |
|||||
|
Lonza, RAFT |
▪ | ▪ | ▪ | ▪ | ▪ |
Collagen, RAFT (Real Architecture For 3D Tissue) |
||||||||
|
Global Cell Solutions, GEM |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Alginate microcarrier ferromagnetic beads |
|||||||
|
InSphero, GravityPLUS |
▪ | ▪ | ▪ |
Hanging drop ECM-free |
||||||||||
|
DenovoMATRIX, screenMATRIX |
▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ | ▪ |
Glycosaminoglycan PEG-Peptide biomatrix |