Mykoplasmen-Kontaminationen in der Zellkultur
Mykoplasmen sind zusammen mit Kreuz-Kontaminationen die beiden schlimmsten Probleme, die wir in der Zellkultur haben. Darüber hinaus sind Mykoplasmen aber wahrscheinlich die hinterhältigsten mikrobiologischen Zellkultur-Kontaminationen, die wir kennen!
Warum ?
- Weil man sie im Lichtmikroskop nicht sehen kann,
- weil die Zellen nicht so schnell "umbringen" wie andere Bakterien,
- weil sie in vielen Zelllinien schon Jahrzehnte vorhanden sind und
- weil sie jeden Tag mit uns ins Zellkulturlabor gelangen.
Das schlimmste an Mykoplasmen ist jedoch, dass sie es schaffen, Zellkultivierer davon zu überzeugen, dass nur andere sie haben und sie sie anhaltend ignorieren. Anfragen bei Zellkultur-Nutzern durch verschiedene Zellbanken ergaben, dass momentan nur ca. 30% der Zellkulturlabore auf Mykoplasmen testen und die wenigsten testen regelmäßig. Daher ist es allerdings nicht erstaunlich, dass die Kontaminationsraten je nach Labor zwischen 4 und 90% liegen.
Dass das keine gute Idee ist, wollen wir hier gerne deutlich machen, indem wir beschreiben, was Mykoplasmen sind und wie man sie erkennen kann. Weitere Hilfestellung bekommen Sie auch in unseren Kursen Kontaminationsvermeidung, Aseptik und Hygiene, Qualitätsmanagement sowie Mykoplasmennachweis und Eliminierung.
Die folgenden Themen finden Sie auf dieser Seite:
Ursprung von Mykoplasmen-Kontaminationen
Mykoplasmen-Einordnung
Mykoplasmen sind Bakterien und gehören zur Klasse der Mollicutes (Weichhäuter), weil sie natürlicherweise keine Zellwand ausbilden. Früher nannte man sie auch PPLO (pleuropneumonia-like organisms), dieser Begriff wird heute jedoch nur noch selten verwendet.
Da Mykoplasmen keine Zellwand ausbilden, sind sie vollkommen resistent gegen die Antibiotika, die wir normalerweise in der Zellkultur einsetzen, also z.B. Penicillin, Streptomycin, Gentamycin etc.
Außerdem bewirkt die fehlende Zellwand, dass Mykoplasmen 0,2µm Membranfilter passieren können. Der aufgebrachte Druck drückt die sich verformenden Mykoplasmen durch die Poren, auch wenn sie eigentlich größer als 0,2 µm sind!

Auswirkungen auf Zellkulturen
Mykoplasmen sind Parasiten! D.h. sie nehmen zum einen Nährstoffe aus dem Zellkulturmedium auf, aber sie entziehen den Zellen auch weitere Stoffe, die sie nicht selbst herstellen können. Darüber hinaus produzieren sie jedoch auch noch Toxine, die die Zellen zusätzlich schädigen. Hier eine Liste der nachgewiesenen Effekte.
|
Verbreitung von Mykoplasmen-Kontaminationen in Zellkulturen
Die internationalen Zellbanken, allen voran die DSMZ, testen regelmäßig die Zelllinien, die ihnen zugeschickt werden und publizieren die Ergebnisse. Hier einige der Ergebnisse in Kurzform.
|
Ursprung von Mykoplasmen-Kontaminationen
Mykoplasmen-Kontaminationen fallen generell in 2 Kategorien: a) direkte und b) indirekte Kontamination. Unter direkten Kontaminationen versteht man, dass kontaminierte Lösungen zu den Zellen gegeben werden (z.B. FCS, Wachstumsfaktoren, Coating-Proteine). Indirekte Kontaminationen kommen meist durch Fehler in der sterilen Arbeitstechnik oder durch mangelnde Qualitätskontrolle zu Stande.
|
Mykoplasmen-Nachweis-Methoden
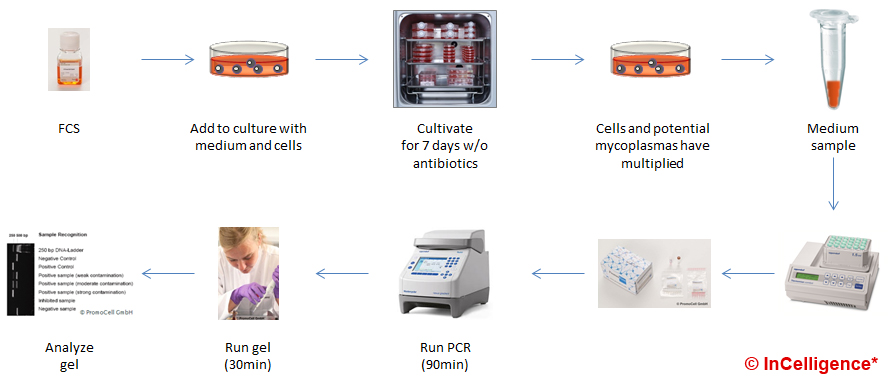
Unter den Nachweis-Methoden für Mykoplasmen gibt es zwei besonders empfehlenswerte. Zum einen ein schneller und einfacher Nachweis mit DAPI oder Hoechst-Farbstoffen und zum zweiten der sensitive und günstige Nachweis über PCR. Hier sind zwei Beispiele dargestellt, wie man z.B. eine neue Charge von FCS testen kann.
Im ersten Beispiel wird das zu testende Reagenz (hier z.B. eine neue FCS Charge) zu einer sauberen Zellkultur gegeben und diese 7 Tage damit kultiviert (länger ist natürlich sicherer). Danach wird mit einem kommerziellen Kit der Zellkultur-Überstand mittels PCR getestet.
Images from InCelligence, Eppendorf AG, PromoCell GmbH and F. Timm Seabra Souza
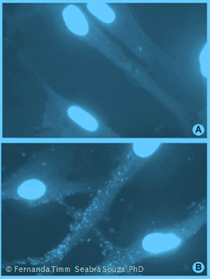
Im zweiten Beispiel geht man identisch vor, allerdings fixiert man die Zellen am Ende und färbt sie mit DAPI oder Hoechst. Nun kann man eventuelle Mykoplasmen-Kontaminationen im Fluoreszenz-Mikroskop erkennen. Dieser Nachweis ist allerdings deutlich weniger sensitiv als die PCR. Wer diese Methode als einzige nutzen möchte, sollte immer eine Inkubationszeit von mindestens 14-21 Tagen einhalten.

Images from InCelligence, Eppendorf AG, PromoCell GmbH and F. Timm Seabra Souza
Mykoplasmen-Nachweis-Kits PCR - Video-Demo
| Firma | Bemerkungen: Research kits |
| Beispiel-Video |
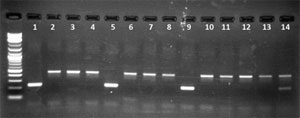
In unserem MOOC haben wir einKit benutzt, um in einem Video zu demonstrieren wie eine PCR funktioniert. Dieses Kit gibt es leider nicht mehr, aber die Methode beleibt ja gleich. Ergebnis Beispiele:
Legende PCR gel links: Legende PCR gel rechts: |
Mykoplasmen-Nachweis-Kits PCR - Pharma-Niveau (Freigabeprüfungen, validiert)
| Firma | Methode/NWG/GMP | Spezies | Preis | Bemerkungen: Pharma-Kits |
| Greiner BioOne |
PCR- Mikroarray <10 KBE GMP: + |
alle (ja/nein), (EuPharm 9 von 7-9) 40 (identifiziert) |
>560 |
Positivkontrolle: ja |
| Roche |
PCR-Gel <10 KBE GMP: + |
alle (ja/nein), (EuPharm ? von 7-9) | >500 |
Positivkontrolle: ja |
* Price is price/sample when purchasing a normal size kit including all reagents.
Mykoplasmen-Nachweis-Kits PCR - Forschung und Pharma-QK
| Firma | Methode/NWG/GMP | Spezies | Preis | Bemerkungen: Research kits |
| Sartorius |
qPCR keine Angabe GMP: - |
Semi-quantitativ
|
Validiert nach EP 2.6.7 für: sensitivity, specificity, and robustness. Erfüllt auch Kriterien der USP und JP. | |
| Southern Biotech |
PCR 1000-2500 KBE GMP: - |
20 (ja/nein) =
|
Positivkontrolle: ja Interne Kontrolle: ja |
|
| Minerva |
PCR-Gel <1000-2500 KBE GMP: - |
28 (ja/nein) =
|
<10,34 | Positivkontrolle: ja Interne Kontrolle: ja Dieser Kit stellt eine methodische Vereinfachung dar. Die Tubes enthalten bereits Nukleotide, der MasterMix ist fertig und enthält auch schon Ladepuffer. Damit entfallen viele Pipettierschritte. Außerdem ist die Positivkontrolle in eigenen Tubes vorgelegt, sodass seltener Kontaminationen vorkommen. 4 Pipettierschritte insg. VenorGeM Advance |
| Sigma |
PCR-Gel <1000-2500 KBE GMP: - |
19 (ja/nein) =
|
<9,96 | Positivkontrolle: ja Interne Kontrolle: ja Dieser Kit stellt eine methodische Vereinfachung dar. Die Tubes enthalten bereits Nukleotide, der MasterMix ist fertig und enthält auch schon Ladepuffer. Damit entfallen viele Pipettierschritte. Außerdem ist die Positivkontrolle in eigenen Tubes vorgelegt, sodass seltener Kontaminationen vorkommen. 3 Pipettierschritte insg. |
| Millepore |
rRNA keine Angabe GMP: - |
Keine Angabe | Milliprobe. Leider ist die Seite wirklich schlecht. Man findet den Test kaum bis gar nicht und wenn doch findet man leider keine Infos. Eurofins scheint diesen Mykoplasmennachweis zu verwenden. | |
| Firma | Methode/NWG/GMP | Spezies | Preis | Bemerkungen:keine interne Kontrolle |
| R&D Systems |
Hybridization- ELISA ~15 - 2500 KBE GMP: - |
8 (ja/nein) =
|
~4 | Positivkontrolle: ja Interne Kontrolle: nein In diesem Assay wird rRNA von Mykoplasmen über einen ELISA colorimetrisch nachgewiesen. Der Assay kreuzreagiert mit Lactobacillus und ist damit nicht mykoplasmen-spezifisch. MycoProbe® |
| Agilent |
PCR-Gel n.a. GMP: - |
die meisten (ja/nein) | ~9,8 | Positivkontrolle: ja Interne Kontrolle: nein Dieser Kit enthält nur Primer. Polymerase und Reaktionspuffer sind nicht enthalten. Über einen Restriktionsverdau können 5 Spezies identifiziert werden. Es wird nicht angegeben, welche Mykoplasmen genau mit "die meisten" gemeint ist. Die interne Kontrolle ist nur eine DNA und somit eine PCR-Kontrolle. Mycoplasma Plus Primer set |
* Price is price/sample when purchasing a normal size kit including all reagents.
Mykoplasmen-Nachweis-Kits - weniger sensitive Methoden
| Firma | Methode/NWG/GMP | Spezies | Preis | Bemerkungen: Pharma-Kits |
| N.A. |
Hoechst oder DAPI Färbung NWG: 1 bis 100 Mio. GMP: Inprozesskontrolle |
Alle. | Immunfluoreszenz mittels DAPI oder Hoechst-Färbung zeigt Mykoplasmen als Schleier auf der Zelloberfläche. Wenig sensitiv ohne langwierigen Assay. Aber schnell und extrem günstig. Für Forschungslabore die mikroskopieren immer eine gute Zusatztestung! | |
| Lonza |
Lumineszenz NWG: 10.000 bis 1.000.000/mL GMP: nein |
Keine Angabe. | Photometrische Bestimmung von Reaktionsprodukten im Zellkulturmedium nach Zugabe eines Reagenzes mittels ELISA Reader. Schnell. | |
| Invivogen |
Isothermale PCR, Testkammern NWG: mit 100 CFU/mL angegeben GMP: nein |
U.a.: M. orale, M. hyorhinis, M. arginini, M. fermentans, M. hominis, and A. laidlawii. | Testkammern, ähnlich den Corona-Schnelltests mit 1 oder 2 Banden nach Ende der Reaktion, Schnell. | |
| Invivogen |
Zell-basierte Absorbanz NWG: 5*102-5*105 CFU/ml GMP: nein |
Wahrscheinlich mind. M. orale, M. hyorhinis, M. arginini, M. fermentans, M. hominis. Keine genau Angabe | Mit Hilfe einer Detektorzelllinie werden Mykoplasmen im Zellkulturmedium von Testzellen nachgewiesen. Messung über ELISA Reader oder optisch innerhalb einer Platte. |
* Price is price/sample when purchasing a normal size kit including all reagents.
Anforderungen der EuPharm.:
Folgende Stämme werden für die Validierung eines Mykoplasmen-Nachweises gemäß Pharmacopoiea als Kontrollstämme gefordert. Die Nachweisgrenzen, die man erreichen muss, liegen je nach Test bei 10-100 KBE pro ml. Je nach Produkt wird ein (vorgegebener) Stamm auch als Positivkontrolle mitgetestet:
- A. laidlawii
- M. fermentans
- M. hyorhinis (where cell-culture enrichment is used, a fastidious strain such as ATCC 29052 is included)
- M. orale
- M. pneumoniae or M. gallisepticum
- M. synoviae (where there is use of or exposure to avian material during production)
- Mycoplasma arginini
- Spiroplasma citri (where there is use of or exposure to insect or plant material during production)
Die wichtigsten Zellkultur-Mykoplasmen sind
- M. orale
- M. hyorhinis
- M. arginini
- M. fermentans
- M. salivarium
- M. hominis